Verbraucher haben einen rechtlichen Anspruch auf Information über Inhaltsstoffe und Herstellungsverfahren ihrer Lebensmittel. Diese Information kann über eine gesetzlich vorgeschriebene oder freiwillige Etikettierung erfolgen. Die Etikettierung muß nicht nur sachgerecht und nicht irreführend sein, sondern auch überprüfbar sein.
Nach der Novel Food VO müssen Lebensmittel und Lebensmittelzutaten gekennzeichnet werden, wenn sie
- lebende gentechnische modifizierte Organismen darstellen oder enthalten,
- Stoffe enthalten, die für bestimmte Personengruppen eine Beeinträchtigung
ihrer Gesundheit mit sich bringen,
- Stoffe enthalten, die ethische Bedenken bei bestimmten Gruppen auslösen
können,
- nicht gleichwertig zu traditionellen Lebensmitteln sind.
Eine Etikettierungspflicht besteht nur dann, wenn auf Grund von Analysendaten und einer wissenschaftlichen Beurteilung Unterschiede zu den entsprechenden konventionellen Erzeugnissen nachgewiesen werden können (Art. 8, (1a) [7]. Kennzeichnung und Überprüfbarkeit, d. h. die Nachweisbarkeit der gentechnischen Modifikationen und die richtige Etikettierung sind eng miteinander verbunden.
Für die Nachweisbarkeit gentechnisch modifizierter Lebensmittel muß zwischen Erzeugnissen mit und ohne DNA unterschieden werden (Abb. 7).
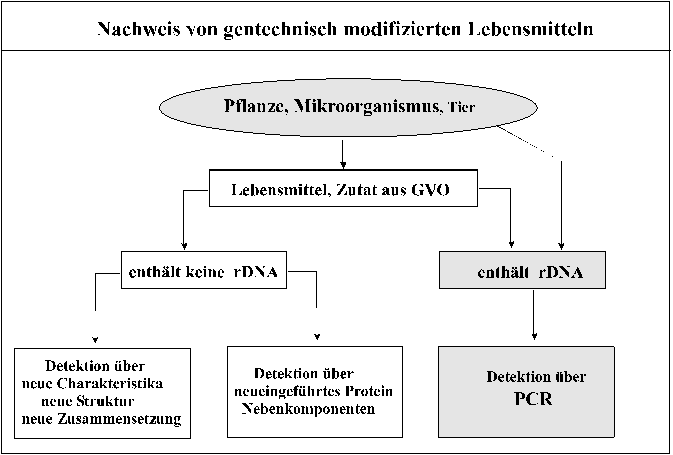
Abb. 7: Identifizierung von gentechnisch modifizierten
Lebensmitteln
Gentechnisch modifizierte Lebensmittel können grundsätzlich auf drei Ebenen identifiziert werden (Abb.7) [14]. Je nach Modifizierung und der Auswirkung auf das Produkt sowie in Abhängigkeit zur Verarbeitungstiefe des Lebensmittels eignen sich als Nachweis:
- die neu eingeführte DNA, (rDNA) bzw. Teile davon ( keine Selbstklonierung),
- das (die) neueingeführte(n) Protein(e),
- Änderungen in der quantitativen Zusammensetzung des Produkts.
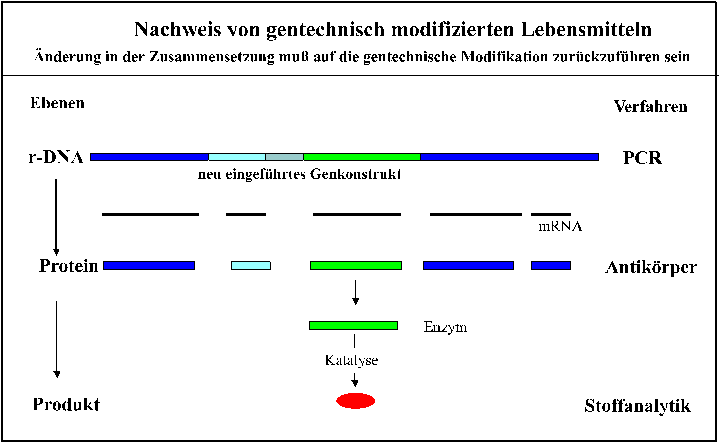
Abb. 8: Nachweismöglichkeiten für gentechnisch
modifizierte Lebensmittel
Der Nachweis der DNA erfolgt über die
Polymerase-Kettenreaktion (PCR) mit spezifischen Primern oder der
Sonden-Technik; Proteine werden spezifisch durch immunologische Verfahren erfaßt,
Änderungen in der quantitativen Zusammensetzung durch die gängigen
analytischen Verfahren wie Chromatographie, Spektroskopie und Enzymologie
festgestellt.
Für den Nachweis der DNA stellt die PCR-Methode heute die am häufigsten angewandte Methode dar. Bei der PCR wird durch die enzymatische Reaktion der Polymerase die Menge der nachzuweisende DNA in Abhängigkeit der Reaktionszyklen vervielfältigt (Tab. 16) und so die hohe Sensitivität erreicht (Tab. 17). Bei anderen analytischen Methoden wird die tatsächlich vorhandene Menge der nachzuweisenden Substanz erfaßt und die Empfindlichkeit des Verfahrens durch die Verstärkung des Meßsignals erreicht.
Voraussetzung für das PCR-Verfahren ist die Kenntnis der neu eingeführten DNA-Sequenz (zur Ableitung der korrespondierenden Primer) und das Vorhandensein der rDNA in dem Produkt.
Die Arbeitsschritte gliedern sich in:
- Extraktion der DNA und Abtrennung von PCR-Inhibitioren aus der
Lebensmittelmatrix.
Die Extraktion einer PCR-geeigneten DNA stellt immer ein Problem bei einzelnen Lebensmitteln dar. Die Anwesenheit von Hemmstoffen beeinflußt die Sensitivität negativ bis hin zur völligen Inhibierung der enzymatischen Reaktion. Da keine einheitlichen und für alle Matrices gültigen Extraktionverfahren vorhanden sind, kann unterschiedliche, bis hin zu falsch negativen Ergebnisse erhalten.
- PCR-Reaktion - Amplifizierung der DNA
Hier besteht die Gefahr des unspezifischen Bindens von Primern, vor allem bei sehr heterogenen DNA-Populationen.
- Elektrophoretische Auftrennung der amplifizierten DNA im Agrarose-Gel
Bei der Elektrophorese werden die DNA-Fragmente nach ihrer Größe (Kettenlänge) aufgetrennt. Ein PCR-Produkt der erwarteten Größe kann nur als Hinweis und nicht als zuverlässiges Kriterium gewertet werden. Es kann durchaus vorkommen, daß unspezifische Fragmente der gesuchten Kettenlänge auftreten, die zu falsch-positiven Ergebnissen führen.
- Verifizierung der gesuchten PCR-Produkte
Durch sekundäre Verfahren wie Sondenhydridisierung, Restriktionsverdau, Sequenzierung, nested PCR usw. muß nachgewiesen werden, daß das gebildete PCR-Produkt spezifisch für die gesuchte neueingeführte Sequenz ist.
|
|
|
|||
| 1
2 4 5 6 7 8 10 12 14 16 20 24 28 30 32 |
0
0 4 8 16 32 64 256 1.024 4.096 16.384 262.144 4.194.304 67.108.864 268.435.456 1.073.741.824 |
|
||
Tab. 16: Amplifizierung von DNA-Fragmenten
(theoretisch)
| Anteil in Prozent
an rekombinanter genomischer DNA |
Anzahl der Zkylen 32 38 48 |
|||||
| 10
1 0,1 0,01 0,001 0,0001 |
|
|
|
|||
Tab. 17: Sensitivität der PCR
Für die Ableitung der Primer können Sequenzen aus
- dem Zielgen
- Marker- oder Selektionsgenen
- Regulatorgenen
verwendet werden (Tab. 18).
|
|
| Ziel-Gene
CP 4EPSPS: Glyphosat-Toleranz CTP: Chloroplasten-Transpeptid bar: Glufosinat-Toleranz cry 1A(b): Insektenresistenz (Bt-Toxin) |
| Selektionsgene
npt II: Kanamycin / Neomycin - hpt: Hygromycin Antibiotika-Resistenz bla: Ampicillin Antibiotika-Resistenz dhfr: Dihydroxyfolat-Reduktase |
| Regulatorgene
35 S: 35 S Promotor nos: Nopalin Synthase Gen Terminator |
Tab. 18: Häufig verwendete Gene für die Ableitung von PCR-Primern und DNA-Sonden
Für einfache Screening-Zwecke, insbesondere bei
pflanzlichen Produkten, eignen sich Sequenzen aus den Promotor- und dem
Terminatorbereich, da diese bei sehr vielen transgenen Pflanzen identisch
sind. Selbstverständlich können hiermit nicht alle transgenen
Pflanzen erfaßt werden und stets muß sich noch ein spezifischer
Nachweis (z.B. Primer-Kombinationen aus Regulator- und Zielgen) durchgeführt
werden. Die Bereiche für das Screening- und das spezifische
Nachweisverfahren für Roundup-Ready® Sojabohnen sind in Abbildung. 9
gezeigt.
Die PCR kann nicht angewandt werden, wenn
- die Mutation bzw. das neueingeführte Gen (-konstrukt) in seiner
Struktur nicht bekannt sind,
- die neueingeführte DNA bereits endogen im Organismus vorhanden war,
- die DNA nicht PCR-amplifizierbar ist.
Ein Problem für den Nachweis auf der DNA-Ebene stellen verarbeitete Lebensmittel dar. Je tiefer ein Lebensmittel bearbeitet wurde, desto schwieriger wird der Nachweis auf der DNA zu führen sein. Im Verarbeitungsprozess kann die DNA soweit abgebaut worden sein, daß kein Nachweis mit Hilfe der PCR mehr möglich ist, oder daß die Bruchstücke so klein sind, daß der Nachweis ihrer "gentechnischen" Herkunft nicht mehr zuverlässig ist. Die DNA kann z.B. durch Nukleasen-Freisetzung aus dem Lebensmittel, saures Milieu, Scherkräfte usw. fragmentiert werden. Auch ließe sich durch den exogenen Zusatz von Nukleasen-Präparaten während des Herstellungsprozesses die DNA vollständig hydrolysieren. Die Etikettierungspflicht könnte so umgangen werden. Deshalb sind noch andere Nachweisverfahren z.B. auf der Proteinebene notwendig.
Das PCR-Verfahren läßt sich mit großem Aufwand (semi-)quantitativ durchführen. Im Lebensmittelbereich wird dieses Verfahren, insbesondere für die Routinekontrolle großer Probemengen, gegenwärtig noch nicht angewandt. Das "einfache" PCR-Verfahren erlaubt lediglich eine Ja/Nein Entscheidung.

Abb. 9: Nachweismöglichkeiten für Roundup-Ready® Sojabohnen (bp ; Basenpaare)
Im Bereich der Nachweisgrenze liegt eine Aussage häufig
im Ermessensspielraum. Einige Beispiele aus Deutschland und Österreich zu
Erzeugnissen mit Sojalecithin oder Soja aus konventionellen Sojabohnen haben
gezeigt, daß die Analysenergebnisse gleicher Proben in einzelnen
Untersuchungslaboratorien unterschiedlich interpretiert wurden. Heute kann die
Empfindlichkeit der Methode so weit gesteigert werden, daß sich bereits
wenige Moleküle der rDNA nachweisen lassen. Demnächst wird sich in
nahezu allen Produkten rDNA durch carry-over Effekte und
Kreuzkontaminationen finden lassen. Dies würde aber bedeuten, daß
Lebensmittel, die nachweislich nicht gentechnischen Ursprung sind, ebenfalls
gekennzeichnet werden müßten. Um hier eine dem Lebensmittel
sachgerechte Kennzeichnung zu erreichen, ist es notwendig, sehr bald einen
Grenzwert für die Menge an rDNA aufzustellen. Darüber hinaus wäre
es geboten, im EU-Raum die Analysenverfahren zu vereinheitlichen. Es sollte für
den gleichen Rohstoff, das gleiche Lebensmittel eine einheitliche Probenmenge,
ein Aufarbeitungsverfahren, und die Anzahl der Zyklen (entsprechend einer
Referenzprobe) festgelegt werden. Es kann nicht angehen, daß in einem
Mitgliedsstaat 25 und in einem anderen 48 PCR-Zyklen für das gleiche
Produkt eingesetzt werden.
Der Nachweis des neueingeführten Proteins hat in Hinblick auf Verbraucherschutz und -infor- mation an sich eine größere Relevanz als die Identifikation der rDNA. Von einem Protein kann eine Gefährdung für Atopiker (Allergiker) ausgehen und für diese sensitive Personengruppe wäre es zur Meidung dieses Produktes wichtig zu wissen, aus welchem Organismus das neue Protein stammt. Nur die Information, daß es sich um ein gentechnisch modifiziertes Lebensmittel handelt, ist unzureichend.
Mit Hilfe von spezifischen Antikörpern und immun-chemischen Testverfahren kann das neueingeführte Protein detektiert und in der Regel auch quantifiziert werden [15]. Diese immunologischen Verfahren sind nicht neu; sie werden standardmäßig in der klinischen Diagnostik und Lebensmittelüberwachung durchgeführt. Viele unterschiedliche Verfahren sind hier entwickelt worden. Grundsätzlich ist es immer eine Zwei- schrittechnik:
- Bindung des Proteins an den korrespondierenden spezifischen Antikörper und
- die quantifizierbare Nachweisreaktion.

Abb.10: Schema des ELISA-Testverfahren
In Abb. 10 ist ein typischer ELISA-Test(enzyme
linked immunosorbent assay) schematisch dargestellt, bei dem die Antikörper
an eine Matrix gebunden sind. Die Quantifizierung des primären
Antigen-Antikörper-Komplexes erfolgt über ein an den sekundären
Antikörper gekoppeltes Enzym. Speziell an gentechnisch modifizierte
Lebensmittel sind die Verfahren noch nicht adaptiert und etabliert und für
die meisten Proteine fehlen die spezifischen Antikörper. Die
Identifizierung der Proteine erfolgt über die spezifische Antigen - Antkörper-
Reaktion [16]. Wichtig ist hierbei, daß die Antikörper ganz
spezifisch nur das neueingeführte Protein erkennen und keine Bindung
(Kreuzreaktion) mit anderen, aber strukturell sehr ähnlichen Proteinen
(Peptidstrukturen) eingehen. Hierin ist noch eines der Hauptprobleme für
den Proteinnachweis zu sehen. Ein weiteres Problem ist, daß das
nachzuweisende Protein tatsächlich nur aus dem gentechnisch modifizierten
Produkt stammt und nicht aus einer natürlichen mikrobiellen Kontamination
des Lebensmittels. Im Punkte der Spezifität auf eine gentechnische Veränderung
ist der DNA-Nachweis mit seinen überlappenden Sequenzen aus z.B.
Regulator- und Zielgen dem Proteinnachweis überlegen.
Der immunologische Nachweis versagt natürlich immer
dann, wenn das Gen für das nachzuweisende Protein in dem zum Verzehr
bestimmten Pflanzenorgan nicht / kaum exprimiert wird (z.B. Bt-Toxin im
Maiskorn). Der immunologische Nachweis wird seine Grenzen im pMol-Bereich
finden; er ist nicht so empfindlich wie das PCR-Verfahren. Aber solche hohen
Empfindlichkeiten sind für den Nachweis einer gentechnischen Modifikation
sicherlich nicht notwendig. Im Lebensmittelbereich und insbesondere bei
Bulkware ist eine Nachweisgrenze im Prozentbereich ausreichend.
2.9 Kennzeichnung "Gentechnikfrei"
Nach der Novel Food Verordnung ist auch eine Etikettierung "gentechnikfrei" möglich. Einer solchen freiwilligen Kenntlichmachung stehen grundsätzlich keine gesetzlichen Hindernisse entgegen. Diese Etikettierung ist jedoch sehr problematisch und kann leicht zur Verbrauchertäuschung führen. Die Situation wird aber dadurch erschwert, daß Begriffe wie "gentechnikfrei" oder "Ohne Gentechnik" nicht definiert sind. Eine rasche Klärung des Begriffes "gen- technikfrei" durch die EU-Kommission wäre notwendig. Die Definition und die Bedeutung von "gentechnikfrei" wird stark von der Einstellung der Öffentlichkeit zur Gentechnik abhängen. Unter "gentechnikfrei" könnte verstanden werden, daß das Lebensmittel
a) während seiner Genese in keiner Weise mit der Gentechnik in Berührung gekommen ist,
b) keine isolierten Produkte oder Bestandteile aus GVO enthält,
c) keine rekombinierte DNA enthält.
Der Punkt c) ist zwar leicht überprüfbar, aber würde der Bedeutung von "gentechnikfrei" nicht genügeleisten und sehr leicht an die Grenze der Verbrauchertäuschung führen. So könnte z.B. durch eine technische Bearbeitung Protein oder Lecithin aus transgenen Sojabohnen frei von rDNA gemacht werden, aber das Erzeugnis dürfte nicht als ein Produkt "Ohne Gentechnik" gekennzeichnet werden. Ähnliches würde für Käse gelten, bei dem die Milch mit Chymosin aus GVO dickgelegt wurde. Bei noch weiterem Ausbau der PCR-Empfindlichkeit werden sich in naher Zukunft generell in allen Lebensmitteln Spuren von rDNA nachweisen lassen können.
Punkt b) bezieht sich auf alle mit oder aus GVO gewonnenen Produkte (Enzyme, Vitamine, Aminosäuren, Stärke, Zucker, Öl, Protein, Lecithin). Alle diese Produkte entsprechen gegenwärtig den traditionellen Erzeugnissen; sie sind nicht gentechnisch verändert. Eine Absicherung, daß solche Produkte nicht aus GVO stammen, kann durch eine aufwendige, strenge, behördliche Überwachung und technische Verfahrensumstellungen mindestens teilweise erreicht werden. Dennoch kann kaum jemand eine Garantie für die Richtigkeit der Kennzeichnung "gentechnikfrei" abgeben.
Punkt a) käme den Vorstellungen vielen Verbrauchern
und Kritikern der Gentechnik sicherlich am nächsten. Allerdings ist eine
solche Forderung kaum realisierbar. Kühe, die mit einem Futter gefüttert
werden, das Anteile von transgenen Pflanzen (z.B. Soja-, Mais-, Rapsschrot)
enthält, liefern traditionelle(s), nicht gentechnisch veränderte(s)
Milch oder Fleisch. Sie und die davon abgeleiteten Erzeugnisse sind
gentechnisch unmodifiziert. Eine ähnliche Sachlage ergibt sich für
die fermentative Gewinnung von Enzymen aus konventionellen Mikroorganismen.
Die meisten Fermentationsmedien enthalten heute isolierte Produkte aus GVO.
Die Produktionsorganismen verstoffwechseln diese und integrieren sie in
zelleigene Komponenten, z.B. als Aminosäuren in Proteine. Weder die
Produktionsorganismen noch die Enzyme sind gentechnisch modifiziert und erst
recht nicht Lebensmittel, die mit solchen konventionellen Enzymen verarbeitet
wurden. Hier stellt sich zwingend die Frage, ob konventionelle Enzyme als "gentechnikfrei"
bezeichnet werden dürfen. Ähnliches würde auch für Maisstärkehydrolyseprodukte
gelten, die Lebensmitteln zugesetzt werden. Ein Erfrischungsgetränk mit
solchem Fructosesirup ist kein gentechnisch modifiziertes Getränk. Es wäre
vom wissenschaftlichen Standpunkt als "gentechnikfrei" zu
bezeichnen. Dennoch sind diese Produkte irgendwie mit der Gentechnik in Berührung
gekommen und dürfen, im Sinne der Vermeidung von Verbrauchertäuschung,
nicht als "Ohne Gentechnik" gekennzeichnet werden. Solange die
Gesetzeslage zur Bedeutung von "gentechnikfrei" noch völlig
ungeklärt ist und allein der grenzwertfreie Nachweis von rDNA als
Kriterium für ein Gentech-Produkt angesehen wird, ist eine Kennzeichnung "gentechnikfrei"
ungemein problematisch. Darüber hinaus kann bei Bulkware und angesichts
internationaler Warenströme kaum ein Rohstofflieferant die Garantie
abgeben, daß sein Produkt frei von "Gentechnik" ist.
1. Gesetz über den Verkehr mit Lebensmittel, Tabakerzeugnissen, kosmetischen Mitteln und sonstigen Bedarfsgegenstände (Lebensmittel und Bedarfsgegenstände-Gesetz; LMBG) in der Fassung der Bekanntmachung vom 8 Juli 1993, BGBl. I; S. 1945, berichtigt S. 2652
2. Käseverordnung in der Bekanntgabe der Neufassung vom 14.4.1986; BGBl. I, S.420
3. Allgemeinverfügung nach § 47 a des LMBG; Einfuhr und Inverkehrbringen des rekombinierten Labaustaustauschstoffes Chymosin aus GVO. 11. März 1997, (S.2836) Bundesanzeiger
4. Gesetz zur Regelung von Fragen der Gentechnik (GenTG) vom 16. Dezember 1993. BGBl I, S. 2066
5. Richtlinie des Rates vom 23. April 1990 über die Anwendung genetisch veränderter Mikroorganismen in geschlossenen Systemen (90/219/EWG), Amtblatt der Europäischen Gemeinschaften Nr. L 117, 1, 08.05.1990
6. Richtlinie des Rates vom 23. April 1990 über die absichtliche Freisetzung von genetisch veränderten Organismen in die Umwelt. Amtsblatt der Europäischen Gemeinschaften Nr.L 117, 15, 08.05.1990
7. Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates vom 27. Januar 1997 über neuartige Lebensmittel und neuartige Lebensmittelzutaten. Amtsblatt der Europäischen Gemeinschaften Nr. 4, 1-7
8. Jany, K. D.: Neuartige Lebensmittel. In. Ernährungsbericht 1996. Deutsche Gesellschaft für Ernährung e.V. (DGE) (Ed), Frankfurt 1996
9. Richtline 70/112/EWG des Rates vom 12. Dezember 1978 zur Angleichung der Rechtsvorschriften der Mitgliedsstaaten über die Etikettierung und Aufmachung von Lebensmittel sowie Werbung hierfür. Amtsblatt der Europäischen Gemeinschaften Nr. L 33, 1
10. Entscheidung der Kommission vom 3. April 1996 über das Inverkehrbringen genetisch veränderter Sojabohnen (Glycin max.L.) mit erhöhter Verträglichkeit des Herbizids Glyphosat nach der Richtline 90/220/EWG des Rates. Amtblatt der Europäischen Gemeinschaften L 107/10
11. Verordnung (EG) Nr 1813/97 der Kommission vom 19. September 1997 über Angaben, die zusätzlich zu den in der Richtlinie 79/112/EWG des Rates aufgeführten Angaben auf dem Etikett bestimmter aus genetisch veränderten Organismen hergestellte Lebensmittel vorgeschrieben sind. Amtsblatt der Europäischen Gemeinschaften Nr. L 257, 7; 20.9.1997
12. Verordnung (EG) Nr....../97 der Kommission vom .......über Angaben, die zusätzlich zu den in der Richtlinie 79/112/EWG des Rates aufgeführten Angaben auf dem Etikett bestimmter aus genetisch veränderten Organismen hergestellte Lebensmittel vorgeschrieben sind. (Dok III/5565/97 Rev. 3)
13. Empfehlungen der EU-Kommission vom 29. Juli 1997 zu den wissenschaftlichen Aspekten und zur Darbietung der für Anträge auf Genehmigung des Inverkehrbringens neuartiger Lebensmittel und Lebensmittelzutaten erforderlichen Informationen sowie zur Erstellung der Berichte über die Erstprüfung gemäß der Verordnung (EG) Nr. 258/97 des Europäischen Parlaments und des Rates.
14. Schulze, M.; Hertel, C.; Bögl, K.W.; Schreiber, G.A.: Nachweis mit Hilfe gentechnischer Verfahren hergestellter Lebensmittel. Bundesgesundbl. Sonderheft Dezember 1996, 31-36
15. Aigner, A., Neumann, S: Immunchemie: Grundlagen, Anwendungen, Perspektiven. Gustav Fischer Verlag (1997)
16. Mills, E.N., Plumb, G.W., Morgan, M.R.: ELISA detection of foreign proteins. Meth. Mol. Biol. 49, (1995), 439-451